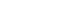【CTC应用文献】循环肿瘤细胞在前列腺癌诊治中的应用与研究

2020年世界癌症报告数据显示,前列腺癌在男性恶性肿瘤发病率的第6位,死亡率的第9位。在中国,大部分患者在初诊时就已经是扩散,预后极为不佳。故而临床专家医生对前列腺癌的早期筛查,以及后期进展到CRPC后的治疗手段非常关注。本文分享了国外前列腺癌的综述文献,作者认为循环肿瘤细胞(CTC)在前列腺癌诊治中具有重大的价值,“与其他恶性肿瘤不同,CTC 计数可能会成为前列腺癌的主要诊断方式”。
“毫无疑问,CTC计数提供了一种非常有吸引力的前列腺诊断方式。前列腺癌人群包括大约有15-20%的高危恶性肿瘤患者,全身扩散的可能性高达80%,首要是骨骼转移。更重要的是,甚至高达 20% 的前列腺癌可能在初诊时就已经扩散。因此,与其他恶性肿瘤不同,CTC 计数可能会成为前列腺癌的主要诊断方式。”
一、前列腺癌流行病学
前列腺癌是最常见的男性恶性肿瘤,全球每年新发病例数约为 160 万。前列腺癌的危险因素包括遗传易感性、前列腺或乳腺恶性肿瘤的家族史,以及年龄较大,诊断时的中位年龄为 72 岁。大约 79% 的前列腺恶性肿瘤在局部阶段被诊断出来。12% 的患者在区域淋巴结侵袭后确诊,另有 5% 在发生局部转移后确诊。前列腺癌的预后主要取决于临床分期。在局部或局部肿瘤患者中,五年生存的可能性约为 100%。然而,远处转移的发展与五年生存率的大幅下降有关,降至约 30%。由于前列腺癌的发病率相对较高,尽管预后相当好,但这种恶性肿瘤每年导致近 370,000 人死亡,使其成为全球第五大癌症死亡原因 [1]。据世界卫生组织国际癌症研究机构统计预测,2020年中国前列腺癌发病率约15.6/10万人,新发病例超11万人,死亡人数超5万人。中国初诊前列腺癌患者的临床分期与西方发达国家相比有很大差异。以美国为例,在初诊前列腺癌患者中,临床局限性病例占76%,局部淋巴结转移病例占13%,远处转移病例仅占6%(其余5%为未知分期病例)。而中国的多中心研究资料显示,仅1/3的初诊前列腺癌患者属于临床局限性前列腺癌,初诊时多数患者已处于中晚期,导致中国前列腺癌患者的总体预后远差于西方发达国家。[2]
二、前列腺癌常规诊断方式
前列腺癌是一种高度遗传异质性的恶性肿瘤,病例范围从生长缓慢或根本不生长的惰性肿瘤到高度进展和侵袭性的去势抵抗性前列腺癌 (CRPC)。根据现行标准,前列腺癌的诊断是建立在活检标本的组织病理学检查的基础上,预后和治疗取决于活检格里森(Gleason)评分和前列腺特异性抗原(PSA)的血清浓度。当前的活检诊断指南推荐至少 8 个点穿刺,而在临床实践中,经直肠方法最常使用 10-12 点穿刺。对于经直肠穿刺活检结果为阴性但仍不能排除前列腺癌的患者,可以考虑采用经会阴穿刺活检。前列腺的磁共振成像 (MRI) 越来越被认为是一种无创技术,能够检测经直肠超声可能遗漏的异常病变,尤其是前叶。也有研究用几种生物标志物以改进对潜在侵袭性前列腺肿瘤的检测。前列腺活检样本的两种可用测试之一是 OncotypeDX,它测量涉及四种不同生物途径的 12 种癌症相关基因和五种参考基因的表达,结果以基因组前列腺评分表示,用于将患者分为极低、低和中危组。另一种分子检测是 Polaris,根据 46 种不同基因的表达对前列腺癌进展的风险进行分层。PSA是前列腺癌细胞分泌的蛋白酶。尽管PSA已被用于诊断前列腺癌和监测治疗结果数十年,但该参数具有严重的局限性,即特异性低。在前列腺的许多非恶性疾病中也报告了 PSA 水平升高,包括良性增生、感染和前列腺梗塞。据报道,只有 40-50% 的血清 PSA 升高的患者通过活检标本的组织病理学检查证实了局部前列腺癌的诊断[1]。除了前列腺癌的诊断外,PSA也用于治疗结果的监测。然而,需要强调的是,PSA是由雄激素依赖性基因编码的。因此,血清雄激素水平的变化或前列腺癌治疗中使用的某些药物对 PSA 基因的直接调节可能导致 PSA 浓度的假性降低,与肿瘤细胞减少无关。
“液体活检”CTC检测
循环肿瘤细胞(CTC)是从原发肿瘤块或继发转移肿瘤脱离并到达外周循环的细胞。由于 CTC 对肿瘤扩散至关重要,因此它们被认为是极具吸引力的预后和预测生物标志物以及治疗结果的衡量标准。在外周血中检测 CTC,称为“液体活检”,是传统组织活检的侵入性较小的替代方法。另外,考虑到前列腺癌肿瘤组织的异质性,以及上述 PSA 的局限性,前列腺恶性肿瘤 CTC 计数在前列腺癌的监测中似乎特别有用。在本篇综述中,我们关注了前列腺恶性肿瘤 CTC 计数的几个方面:转移性和非转移性肿瘤的预后价值、在监测治疗结果中的作用、用作生存的替代标志物以及其他应用。
三、CTC在前列腺癌临床诊疗中的应用
1. CTC对前列腺癌的预后价值
从理论上讲,前列腺癌患者外周血中 CTC 的检测意味着预后比CTC 阴性的人更差。血清 PSA 作为前列腺癌监测的生物标志物,容易受雄激素水平的影响。而CTC独立于雄激素受体介导的信号通路,是肿瘤的可靠标志物。
根据CellSearch方法学,CTC的预后值通常根据美国 FDA 注册文件中规定的临界值确定(每 7.5 mL 外周血≥5 CTC)。该值被广泛认为是前列腺癌的不利预后因素。然而,处于前列腺癌治疗不同阶段的患者在其外周血中 CTC 的数量方面可能存在很大差异。根据文献,在一线治疗之前,高达 75% 的患者存在CTC,但只有 25% 的患者每7.5mL血液中 CTC 数量≥5 个细胞。在一项研究中,当CTC与血清 PSA 和白蛋白浓度一起作为连续变量进行分析时,CTC 数量被证明是生存的重要预测指标。该研究入组了120 名转移性前列腺癌患者,57%的病例检测到每 7.5 mL ≥ 5 个 CTC。骨转移患者CTC 数量高于软组织扩散的患者、有细胞毒性化疗史的患者。CTC 数量与疾病严重程度(如血清 PSA 和骨扫描指数)显示出中度相关性。
总之,已发表的证据表明,CTC计数符合转移性前列腺癌预后标志物的标准。然而,应该考虑到相当大比例的患者可能不会出现每 7.5 mL 外周血 ≥ 5 CTC(传统上用于区分预后好坏的临界值)。因此,未来研究的一个方向是确定一个更低的阈值,更符合预后判断的标准。此外,也发现有一些转移性前列腺癌患者的外周血中缺乏可检测的 CTC,但预后更差。
2. CTC作为治疗的生物标志物
循环肿瘤细胞作为治疗反应标志物首先在IMMC试验中得以证实,CTC计数比治疗后2-5 周血清PSA变化50%是更好的反应标志物。乳酸脱氢酶 (LDH) 是一种由几乎所有癌细胞分泌的既定预后因子,该实验数据进一步分析显示,当与乳酸脱氢酶 (LDH) 的基线活性一起分析时, CTC 计数的预后价值可以进一步提高,在模型中考虑这两个变量比单个参数具有更好的预后价值。
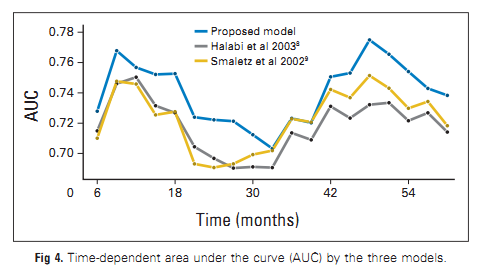
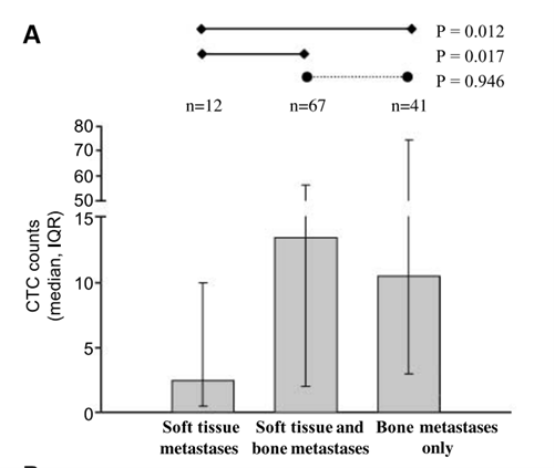
基于上述数据,以及CTC计数与雄激素受体活性无关的事实,该参数被认为是新药醋酸阿比特龙(I期和II期)、恩杂鲁胺试验中的反应标志物。所有这些研究都证实了每 7.5 mL 检测到 ≥5 CTC 以及治疗后从 ≥5 CTC 转变为 <5 CTC 的预后价值。基于这些发现,有人提出CTC计数作为III期临床试验中生存的替代标志。III期试验还验证了CTC计数是比由白蛋白、LDH、血红蛋白和碱性磷酸酶组成的传统预后模型更准确的生存标志物。醋酸阿比特龙(COU-AA-301) 和奥替罗奈 (ELM-PC4) 的2 期和 3 期试验表明,纳入CTC计数提高了对较低死亡风险患者的区分,比基于具有实际生存时间的模型预测的生存时间一致性更高。
这些发现在多项II期和大型III期研究中得到证实。在治疗后的转移性 CRPC (mCRPC) 患者中,使用 CellSearch 系统检测每 7.5 mL 血液中 ≥ 5CTC 与较差的预后相关。尽管上述研究包括大量不同的治疗方案,但它们的结果令人惊讶地一致,表明每 7.5 mL 检测到 ≥5 CTC 与将生存时间缩短约 50%,分别从 25 至 10.5 个月,27.2至14个月和26至13个月。
3. CTC作为转移性前列腺癌的替代存活终点
前列腺恶性肿瘤抗癌药物研究的障碍,就是缺乏临床重要终点的早期生物标志物,譬如生存。在一项前瞻性III期研究(COU-AA-301)中,将CTC计数作为总生存率的潜在替代标志物进行分析。该研究在经化疗的mCRPC患者中比较阿比特龙加泼尼松与安慰剂加泼尼松进行研究,主要终点是总生存期。此外,该研究验证了CTC数量作为唯一参数或结合 LDH 活性分析是否可以作为总体存活率的替代标志。在参与试验的 1195 名患者中,711名患者提供了CTC基线数量和 12 周后 CTC 数量的信息。两个生物标志物(CTC 数量和 LDH 活性)的组合显示满足所有四个预设标准,作为患者个体水平的生存替代标志物。
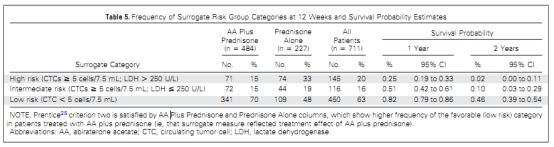
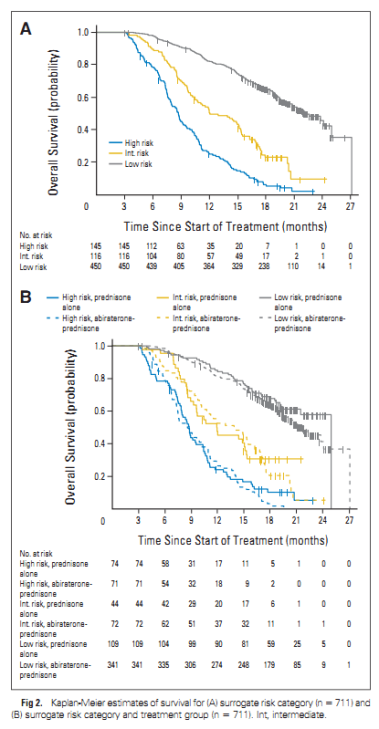
五项前瞻性随机试验(COU-AA-301、AFFIRM、ELM-PC-5、ELM-PC-4、COMET-1)验证了各种定义的终点的准确性,包括 CTC 数量和血清 PSA 作为总生存期的替代标志物。共计分析了 6081 名 mCRPC 患者。在基线和 13 周后测定 CTC 数量和血清PSA,分析了八个不同的终点:12 周后完全消除 CTC,12 周后 CTC 数量从≥5 个细胞转变为 <5 个细胞,以及 CTC 数量和血清 PSA 分别降低 30%、50% 或 70%。前两个终点区分最明显。综上所述,CTC 数量是临床试验中一个有用的参数。

4. CTC用于前列腺癌治疗结果监测
需要强调的是,临床试验在高度选择的患者组使用 CTC计数作为标记,在现实临床环境中监测疾病结果可能完全不同。在现实临床中,CTC 数量是否超过任意定义的阈值可能并不十分重要。医生更加关注患者是否存在 CTC,数量是多少,以及在疾病过程中CTC数量是否发生变化。从理论上讲,可以预期没有 CTC 或每 7.5 mL 血液中少于5 个 CTC 的患者预后较好,并且在疾病过程中 CTC 数量增加到≥ 5 对应于前列腺癌的进展/复发。
CTC计数的预后价值在mCRPC得到证实,但在非去势抵抗性转移性前列腺癌 (ncMPC)患者中的作用研究甚少。很少有研究在这类前列腺癌中验证CTC数量的增加与较差的生存率和更快的疾病进展有关。
在一项前瞻性研究中,包括 30 名局限性前列腺癌 (LPC) 患者、30 名 ncMPC 患者和 30 名健康志愿者,每 7.5 mL ≥4 CTC 的个体的死亡和进展风险分别高出 4.1 倍和 8.5 倍,患者总生存期和无进展生存期显著缩短。每 7.5 mL ≥ 4 的 CTC 数是无进展生存期的独立预测因子。同一项研究以及另外两项研究中,在接受雄激素剥夺治疗的 ncMPC 患者中存在 CTC 作为治疗反应幅度和持续时间的独立预测因子,CTC 数量的阈值范围在 ≥3-5。然而,上述ncMPC研究入组的患者数量较少,因此还有待验证。
5. CTC 在前列腺癌中的其他应用
最近,前列腺癌的分子标志物越来越引起研究人员的兴趣。在这种恶性肿瘤中发现的最常见的遗传缺陷是雄激素受体 (AR) 通路的紊乱。已发表的证据表明,CTC 准确反映了常规活检标本中 AR 基因的扩增状态,因此,可用作分子研究的侵入性较小的材料来源。在使用这种材料的一项研究中,观察到 CTC 内 AR 的核定位与对紫杉烷的抗性之间存在显著相关性。最近,AR 剪接变体,尤其是 ARV7,被证明与对某些激素药物(如恩杂鲁胺和阿比特龙)的抗性有关。已知 AR-V7 蛋白在原发性前列腺癌中很少表达,但在 75% 的 mCRPC 中被发现。重要的是,在接受恩杂鲁胺或阿比特龙治疗的 mCRPC 患者中,在 CTC 中检测到 ARV7 mRNA、较低的 PSA 反应率、较短的无进展生存期和总生存期之间存在联系。同一组进行的另一项研究表明,CTC阴性患者在一线和二线激素治疗后效果最佳,其次是 CTC阳性/ ARV7阴性患者和 CTC 阳性/ARV7 阳性患者。上述研究的结果以及其他研究者提供的数据导致 CTC 首次被批准作为预测性生物标志物,以指导选择紫杉烷或者雄激素受体信号抑制剂 (ARSi)作为二线(或者更高)的治疗选择。
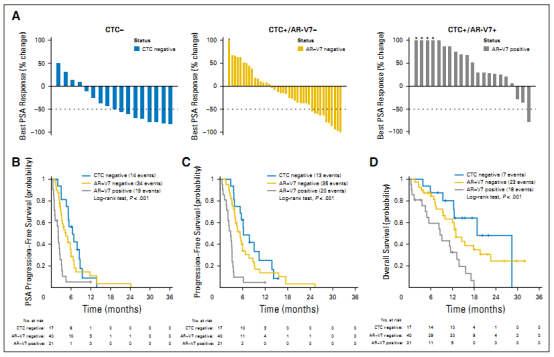
虽然 CTC中的ARV7 mRNA 和 ARV7 蛋白可以预测雄激素途径靶向治疗的耐药性,但这种方法可能存在潜在的缺点。抗雄激素治疗过程中 ARV7 状态可能会发生变化,并且来自同一患者的单个 CTC 中的 ARV7 状态可能是异质的。这一切都可能导致治疗耐药性。此外,越来越多的证据表明,仅ARV7 状态并不能完全解释在临床环境中观察到的耐药性 。最近一项研究的结果表明,除了预测治疗反应外,CTC 的基因组谱也可能与前列腺恶性肿瘤的侵袭性有关。已有文献报道,至少一个CTC中发现缺失两种肿瘤抑制基因与较差的存活率和基因组不稳定性有关。这些发现支持CTC单细胞测序作为表征癌症异质性的非侵入性方法。
结 论
毫无疑问,CTC检测为前列腺癌的诊治提供了一个有吸引力的视角。需要强调的是,前列腺癌患者人群包括大约 15-20% 的高危恶性肿瘤受试者,其全身扩散的可能性非常高(大约 80%),尤其是骨骼。更重要的是,甚至高达 20% 的前列腺癌可能在初步诊断时就已经扩散。因此,与其他恶性肿瘤不同,CTC 计数可能会成为前列腺癌的主要诊断方式。
华得森CytoSorter®CTC检测系统
华得森自2017年开始,在与浙江大学医学院附属第二医院、中山大学孙逸仙纪念医院、浙江大学医学院附属邵逸夫医院合作开展的多中心临床研究,共计纳入1137例病例,评价CytoSorter® CTC检测系统对乳腺癌、肺癌、前列腺癌、结直肠癌的检测效率。研究结果显示,CytoSorter® CTC检测系统在前列腺癌的检测灵敏度96.67%、特异度82.22%,总符合率88%,对于乳腺癌、肺癌、前列腺癌、结直肠癌等癌种均有很好的检出效率,因而获得了NMPA注册批准,成为国内首家获得三类医疗器械注册证CTC检测系统!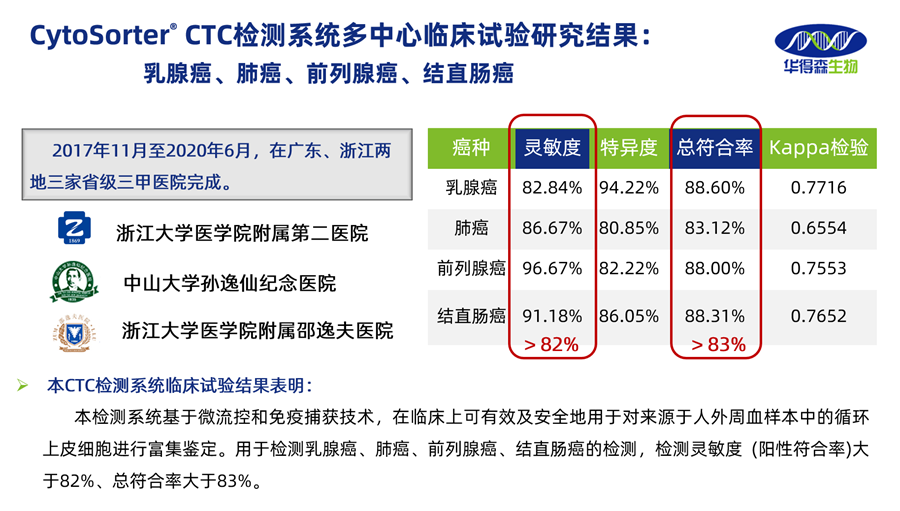
参考文献
1. Wojciech A Cieślikowski, et al. Clinical Relevance ofCirculating Tumor Cells in Prostate Cancer Management. Biomedicines. 2021 Sep8; 9(9):1179.
2. 前列腺癌筛查中国专家共识(2021年版)
3. 华得森CytoSorter多中心临床研究数据